Les batteries sont idéales pour stocker de l’énergie et alimenter les appareils électroniques, qu’il s’agisse de smartphones ou de véhicules électriques. Mais dans les environnements froids, elles peuvent être plus difficiles à recharger et peuvent même prendre feu.
Je suis professeur de génie mécanique et je m’intéresse aux batteries depuis l’université. Je dirige aujourd’hui un groupe de recherche sur les batteries à l’université de Drexel. Au cours des dix dernières années, j’ai vu le prix des batteries lithium-ion s’effondrer tandis que le marché de leur production s’est considérablement élargi. Les projections futures prévoient qu’il pourrait représenter des milliers de GWh par an d’ici 2030.
Mais les batteries lithium-ion sont loin d’être parfaites : cette montée en puissance s’accompagne de risques, comme leur tendance à perdre leur efficacité par temps froid, voire à prendre feu.
Derrière la batterie Li-ion
Le stockage électrochimique de l’énergie dans les batteries fonctionne en stockant l’électricité sous forme d’ions. Les ions sont des atomes qui ont une charge non nulle parce qu’ils ont trop ou pas assez d’électrons.
Lorsque vous branchez votre voiture ou votre téléphone électrique, l’électricité fournie par la prise entraîne ces ions de l’électrode positive de la batterie vers son électrode négative. Les électrodes sont des matériaux solides dans une batterie qui peuvent stocker des ions, et toutes les batteries ont une électrode positive et une électrode négative.
Les électrons traversent la batterie sous forme d’électricité. Chaque électron qui passe dans une électrode, un ion lithium passe également dans la même électrode. Cela assure l’équilibre des charges dans la batterie. Lorsque vous conduisez votre voiture, les ions stockés dans l’électrode négative retournent vers l’électrode positive, et le flux d’électricité qui en résulte alimente le moteur.
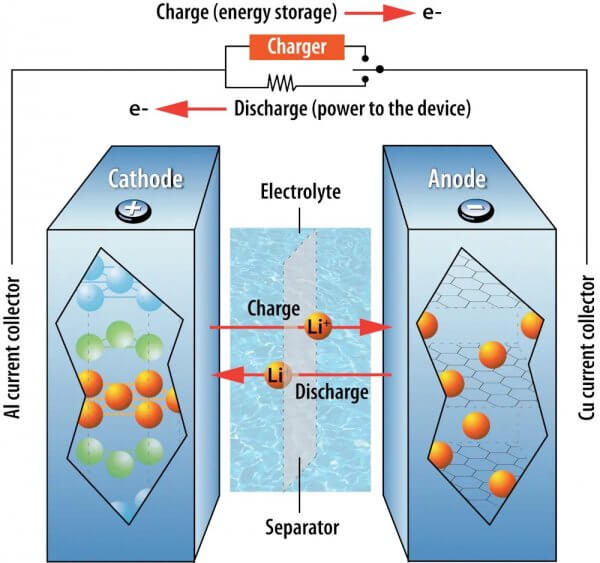
Lorsqu’une batterie lithium-ion fournit de l’énergie à un appareil, les ions lithium – atomes porteurs d’une charge électrique – se déplacent de l’électrode négative, l’anode, à l’électrode positive, la cathode. Les ions se déplacent en sens inverse lors de la recharge. Laboratoire national d’Argonne, CC BY-NC-SA.
Les piles AA ou AAA peuvent alimenter de petits appareils électroniques, mais elles ne peuvent être utilisées qu’une seule fois et ne peuvent pas être rechargées. En revanche, les batteries rechargeables Li-ion peuvent fonctionner pendant des milliers de cycles de charge et de décharge. Pour chaque cycle, elles peuvent également stocker une quantité d’électricité beaucoup plus importante qu’une pile AA ou AAA.
Le lithium étant le métal le plus léger, il a une capacité spécifique élevée, cela signifie qu’il peut stocker une énorme quantité de charge électrique par rapport à son poids. C’est pourquoi les batteries lithium-ion sont utiles non seulement pour l’électronique portable, mais aussi pour alimenter les modes de transport dont le poids ou le volume sont limités, comme les voitures électriques.
Incendies de batteries
Toutefois, les piles au lithium-ion présentent des risques que n’ont pas les piles AA ou AAA. D’une part, elles sont plus susceptibles de s’enflammer. Par exemple, le nombre d’incendies de batteries de vélos électriques dans la ville de New York est passé de 30 à près de 300 au cours des cinq dernières années.
De nombreux problèmes peuvent être à l’origine d’un incendie de batterie. Des cellules mal fabriquées peuvent contenir des défauts, tels que des traces d’impuretés ou des particules laissées par le processus de fabrication, qui augmentent le risque de défaillance interne.
D’autre part, le climat peut également affecter le fonctionnement de la batterie. Les ventes de véhicules électriques ont augmenté aux États-Unis, en particulier dans les régions froides telles que le Nord-Est et le Midwest, où les températures glaciales peuvent entraver les performances des batteries.
Les batteries contiennent des fluides appelés électrolytes, et les températures froides ralentissent l’écoulement des fluides. Ainsi, les électrolytes des piles ralentissent et s’épaississent au froid, ce qui ralentit le mouvement des ions lithium à l’intérieur. Ce ralentissement peut empêcher les ions lithium de s’insérer correctement dans les électrodes. Au lieu de cela, ils peuvent se déposer à la surface de l’électrode et former du lithium métal.
Si une trop grande quantité de lithium se dépose sur la surface de l’électrode pendant la charge, cela peut provoquer un court-circuit interne. Ce processus peut déclencher un incendie de la batterie.
Des batteries plus sûres
Mon groupe de recherche, comme beaucoup d’autres, étudie comment fabriquer des batteries qui fonctionnent plus efficacement dans le froid.
Par exemple, les chercheurs envisagent de remplacer l’électrolyte habituel de la batterie par un électrolyte alternatif qui ne s’épaissit pas à des températures froides. Une autre option potentielle consiste à chauffer le bloc-batterie avant de le charger, de sorte que le processus de chargement se déroule à une température plus chaude.
Mon groupe étudie également de nouveaux types de batteries au-delà du lithium-ion. Il pourrait s’agir de types de batteries plus stables dans des plages de température plus larges, de types qui n’utilisent pas d’électrolytes liquides, ou de batteries qui utilisent du sodium au lieu du lithium. Les batteries sodium-ion pourraient bien fonctionner et coûter moins cher, car le sodium est une ressource très abondante.
Les batteries à l’état solide utilisent des électrolytes solides qui ne sont pas inflammables, ce qui réduit le risque d’incendie. Mais ces batteries ne fonctionnent pas aussi bien que les batteries au lithium-ion, et il faudra donc poursuivre les recherches pour savoir si elles constituent une bonne option.
Les batteries lithium-ion alimentent des technologies utilisées quotidiennement dans tout le pays, et la recherche dans ces domaines vise à trouver des solutions qui rendront cette technologie encore plus sûre pour le consommateur.
Wesley Chang Assistant Professor of Mechanical Engineering and Mechanics, Drexel University
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original sur The Conversation Etats-Unis (en anglais).















